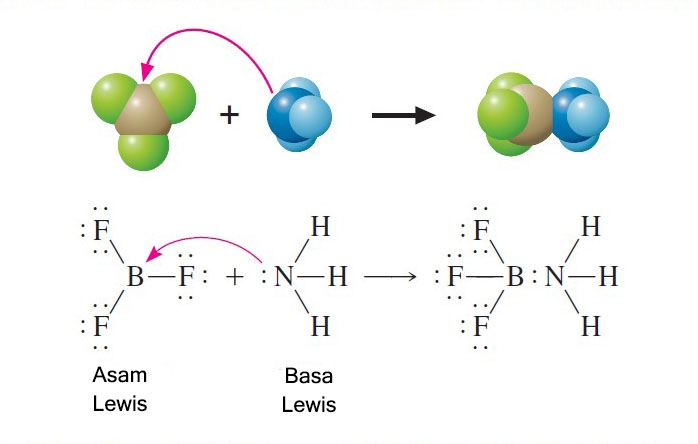
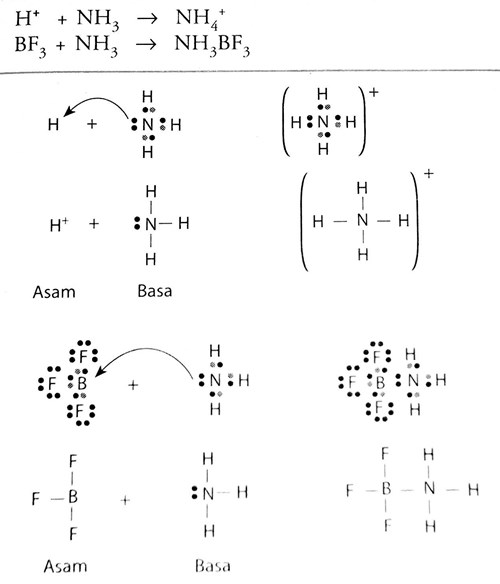
Dalam hal ini boron trifluorida berindak sebagai asam dan amonia sebagai basa. Asam lewis adalah akseptor pasangan elektron bebas.

Konsep Larutan Asam Basa Tama Yudhistira
Contoh asam basa lewis. Asam adalah akseptor pasangan elektron. Diantaranya membahas tentang pengertian asam basa perkembangan teori teori asam basa beserta beberapa contoh soal dan pembahasan. Oleh karena itu contoh contoh pada 2 teori terakhir dapat digunakan sebagai contoh asam basa lewis juga. Tentukan pasangan asam basa konjugasi dari reaksi berikut. Contoh soal asam basa pilihan ganda dan jawaban beserta pembahasan pada tahun 1923 g. Teori asam basa menurut lewis 1923 pada tahun yang sama 1923 lewis mengajukan pandangan yang berbeda terhadap teori asam basa.
Lewis mengemukakan teori asam basa yang lebih luas dibanding kedua teori sebelumnya dengan menekankan pada pasangan elektron yang berkaitan dengan struktur dan ikatanmenurut definisi asam basa lewis. Contoh teori asam dan basa menurut lewis pada gambar diatas telah menunjukan bahwa ion h proton ialah asam lewis karena mampu menerima pasangan elektron sedang nh3 merupakan basa lewis. Reaksi antara boron trifluorida dengan amonia menurut teori ini merupakan reaksi asam basa. Menurut teori asam basa lewis. Teori asam basa lewis. Asam adalah spesi yang mampu menerima pasangan elektron akseptor elektron.
Cara membaca tanda panah melengkung dalam mekanisme reaksi. Basa lewis basa lewis adalah pendonor pasangan elektron. Nh3aq h2ol nh4 aq oh aq penyelesaian. Sebagai contoh reaksi antara bf 3 dan nh 3 merupakan reaksi asambasa di mana bf 3 sebagai asam lewis dan nh 3 sebagai basa lewis. Contoh basa lewis berikut saya kasih list daftar senyawaion yang bertindak sebagai basa lewis. Senyawa yang memiliki orbital kosong pada kulit valensi seperti bf 3 juga dapat berperan sebagai asam.
Dengan menggunakan diagram dot elektron persamaan reaksi kedua spesies ini dapat dituliskan sebagai berikut. Contoh asam basa lewis. Contoh zat yang termasuk dalam basa lewis diantaranya yaitu oh cn nh3 dan lain sebagainya. Agar lebih memahami teori asam basa lewis perhatikan contoh reaksi h dan nh3. Lalu pada reaksi antara bf3 dengan nh3 pada gambar diatas yang merupakan asam lewis ialah bf3 karena bisa menerima sepasang elektron dan teruntuk nh3 ialah basa lewis. Basa adalah donor pasangan elektron.
Contoh asam lewis adalah h b 2 h 6 bf 3 aif 3 ion logam transisi yang bisa membentuk ion kompleks seperti fe 2 cu 2 zn 2 dan sebagainya. Bila kamu belum tahu tentang pengertian asam lewis maka baca pembahasan disini tentang asam basa lewis. Sekali lagi penetapan asam basa pada teori asam basa lewis berdasar ada tidaknya transfer peb dan kemampuan zat lawannya untuk menerima peb itu. Basa lewis merupakan nukleofil karena menyukai untuk menyerang atom yang bermuatan positif pada suatu senyawa. Untuk menjadi asam lewis tidak selalu diperlukan orbital kosong untuk menampung pasangan elektron yang di donorkan oleh basa lewis. Berdasarkan definisi lewis asam yang berperan sebagai spesi penerima pasangan elektron tidak hanya h.
Pasangan asam basa konjugasi dari persamaan diatas adalah h2o oh dan nh4 nh3.